Arnaldo Cioni, Elena Campione, Luca Bianchi
UOSD Dermatologia, Policlinico di Roma Tor Vergata
Il carcinoma basocellulare (BCC) rappresenta la neoplasia più frequente al mondo costituendo il 15% di tutte le neoplasie ed il 75% di tutti i carcinomi cutanei. Il BCC si sviluppa più frequentemente nelle zone foto esposte di soggetti anziani con fototipo chiaro e solo raramente metastatizza. Esistono tre varianti cliniche : (1) BCC nodulare che si localizza generalmente sul viso sotto forma di una papula o nodulo translucido bianco rosato; (2) BCC superficiale che a differenza degli altri insorge più spesso sulla cute del tronco e degli arti in soggetti più giovani; (3) BBC sclerodermiforme che costituisce la variante più rara e si manifesta come una placca bianco-giallastra dura che causa un’intensa sclerosi del derma.
Nel trattare un BCC bisogna tenere conto di quelle che sono le sue caratteristiche cliniche, la sua localizzazione ed estensione ed il risultato estetico che vogliamo ottenere, in modo da poter effettuare la scelta terapeutica più adatta per arrivare alla radicalità oncologica. I due cardini del trattamento sono la chirurgia e la terapia medica topica mediante imiquimod, 5-Fluorouracile ed infine la terapia fotodinamica. L’escissione chirurgica è l’approccio che si preferisce, in quanto ci permette di valutare i margini e quindi la radicalità del trattamento, esistono però delle condizioni che precludono da questa soluzione e rendono il BCC inoperabile.
La non operabilità del BCC può dipendere dalle caratteristiche del tumore : localizzazione in sedi critiche del viso, estensione , difficoltà in fase ricostruttiva , recidiva ; oppure dalle caratteristiche del paziente e quindi dalle sue comorbidità; in questi casi si ricorre alla radioterapia.
Nei casi in cui anche la radioterapia sia controindicata, in seguito ad una valutazione multidisciplinare si parlerà di carcinoma localmente avanzato (laBCC) per il quale oggi esistono terapie target che hanno soppiantato l’impiego dei farmaci chemioterapici classici. Prima del Febbraio 2021 gli inibitori di Sonic hedghog (HHI) Vismodegib e Sonidegib erano gli unici agenti indicati nel trattamento del laBCC , avendo mostrato in alcuni studi di Fase II dei tassi di risposta obiettiva tra il 30% e 60% , tuttavia questa terapia è gravata da seri effetti collaterali che non raramente portano alla sospensione del trattamento, inoltre nella maggioranza dei pazienti trattati non si ha una risposta completa e si può sviluppare una resistenza alla terapia con perdita di efficacia.
Il 5 febbraio 2021 l’FDA ha approvato l’utilizzo del Cemiplimab nel trattamento del BCC localmente avanzato. Il Cemiplimab è un anticorpo monoclonale umanizzato IgG4 diretto contro il PD-1 già approvato per il trattamento del carcinoma squamocellulare metastatico o localmente avanzato che non può essere sottoposto a chirurgia o radioterapia.
Il BCC è una delle neoplasie con la più alta percentuale di mutazioni e questo lo rende particolarmente responsivo a questo tipo di target therapy. L’efficacia di Cemiplimab è stata valutata da uno studio aperto multicentrico randomizzato che ha reclutato pazienti non responsivi a terapia con HHI, intolleranti ad HHI o che hanno avuto una progressione durante il trattamento con HHI. Era inoltre un requisito necessario che non fossero candidabili a chirurgia o radioterapia. Tutti i pazienti sono stati trattati con un regime di 350 mg ogni 3 settimane. Degli 84 pazienti reclutati è stata osservata una risposta obiettiva in 26 pazienti di cui 5 risposte complete e 21 risposte parziali; in 9 pazienti si è avuta una progressione della malattia. Per quanto riguarda gli eventi avversi in corso di trattamento in 40 pazienti si sono verificati eventi avversi di grado 3-4 tra cui ipertensione , colite, astenia, infezioni del tratto urinario ed alterazioni visive; 9 pazienti hanno sospeso il trattamento a causa dell’insorgenza di eventi avversi di grado 2, 3 o 4 tra cui insufficienza adrenocorticale , insufficienza renale acuta, ipofisite, epatite immunomediata, ipotiroidismo ed enterocolite. Sono state riportate 3 morti non correlate al trattamento ma ad altre condizioni preesistenti dei pazienti.
Durante il follow-up è stata confermata l’efficacia long-term del trattamento ed è stato osservato che alcune risposte parziali inizialmente, sono evolute in risposte complete suggerendo che la cinetica di risposta sia più lenta nel BCC rispetto all’SCC e che sia quindi necessaria una maggiore durata del trattamento per una risposta ottimale.
In conclusione, il Cemiplimab può essere considerato una valida opzione nei casi di laBCC non responsivi a Vismodegib o Sonidegib o nei casi in cui questi ultimi siano controindicati.
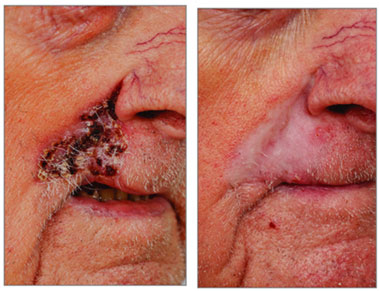
Fig1. Prima e dopo 12 cicli con Cemiplimab.
Referenze:
- Linee guida AIOM Tumori cutanei non melanoma : Carcinoma basocellulare Edizione 2020
- Stratigos AJ, Sekulic A, Peris K, et al. Cemiplimab in locally advanced basal cell carcinoma after hedgehog inhibitor therapy: an open-label, multi-centre, single-arm, phase 2 trial. Lancet Oncol. 2021 Jun;22(6):848-857. doi: 10.1016/S1470-2045(21)00126-1. Epub 2021 May 14. PMID: 34000246.
- Campione E, Di Prete M, Lozzi F, Lanna C, Spallone G, Mazzeo M, Cosio T, Rapanotti C, Dika E, Gaziano R, Orlandi A, Bianchi L. High–Risk Recurrence Basal Cell Carcinoma: Focus on Hedgehog Pathway Inhibitors and Review of the Literature. Chemotherapy. 2020;65(1-2):2-10. doi: 10.1159/000509156. Epub 2020 Aug 10. PMID: 32777789.
- Cosio T, Di Prete M, Campione E. Arsenic Trioxide, Itraconazole, All-Trans Retinoic Acid and Nicotinamide: A Proof of Concept for Combined Treatments with Hedgehog Inhibitors in Advanced Basal Cell Carcinoma. Biomedicines. 2020 Jun 11;8(6):156. doi: 10.3390/biomedicines8060156. PMID: 32545245; PMCID: PMC7344956.
- Fig1. Dumann K, Artz N, Ziemer M. Complete Remission of Basal Cell Carcinoma Following Treatment With Cemiplimab After 2 Years. JAMA Dermatol. 2021 Aug 1;157(8):1004-1006. doi: 10.1001/jamadermatol.2021.2206. PMID: 34232273.
