Terenzio Cosio, Elena Campione, Luca Bianchi
UOSD Dermatologia, Policlinico di Roma Tor Vergata
Il glutatione (GSH) è una molecola non proteica composta da tre aminoacidi (cisteina, acido glutammico e glicina) legati tra loro. Dal punto vista chimico è dunque un tripeptide, in cui la cisteina e la glicina sono legate assieme da un normale legame α-peptidico, mentre il glutammato è legato alla cisteina attraverso un legame γ-peptidico tra il gruppo carbossilico della catena laterale del glutammato e il gruppo amminico della cisteina. La molecola in questo modo presenta il gruppo sulfidrilico della cisteina libero di subire l’ossidazione e di formare un dimero con un’altra molecola di glutatione ossidato, identificato con l’acronimo GSSG, legandosi tramite un ponte disolfuro. Le principali caratteristiche protettive del GSH sono associate al suo meccanismo di difesa contro gli insulti ossidativi.
Nell’ambito dermatologico, gli studi sul glutatione si sono sviluppati fin dagli anni ’70, con un incremento esponenziale a partire dagli anni ’90. I primi studi si focalizzarono sullo studio dell’alterzione redox nel melanoma, sottolineando una perdita complessiva del GSH e disregolazione della ossidazione lipidica di membrana. Si sono poi susseguiti studi nell’ambito del non-melanoma skin cancer (NMSC), evidenziando l’importanza di polimorfisimi genetici della glutatione-S-trasferasi, enzima fondamentale nella riconversione del GSSG in GSH, nell’insorgenza di NMSC soprattutto nei pazienti immunodepressi.
Tuttavia, uno dei limiti di applicazione del glutatione in forma topica o sistemica, è la sua biodisponibilità. Il glutatione è solo in piccola misura biodisponibile per l’uomo; la sua introduzione nell’organismo utilizzando fonti esterne è, infatti, scarsamente efficace per incrementarne la sua concentrazione plasmatica e/o intracellulare, a causa della degradazione ad opera delle proteasi. Pertanto, negli ultimi anni, si sono sviluppate formulazioni in grado di superare questi problemi. Tra i derivati del glutatione, merita particolare attenzione il Butanoil Glutatione.
Il GSH-C4 (butanoil glutatione) è un derivato del GSH ottenuto dalla combinazione del glutatione con un peptide di acido n-butirrico. La coda n-butirrica aggiunta al GSH permette di attraversare la membrana cellulare, aumentando la biodisponibilità.
Inizialmente utilizzato come agente antivirale (Fraternale A, Palamara et al. 2014; Fraternale et al. 2014), si è successivamente scoperto che il GSH-C4 possiede effetti immunomodulatori (Fraternale et al. 2017; Limongi et al. 2019). Si è pertanto proposto l’uso del GSH-C4 nelle patologie infiammatorie cutanee, tra cui la psoriasi e la dermatite seborroica.
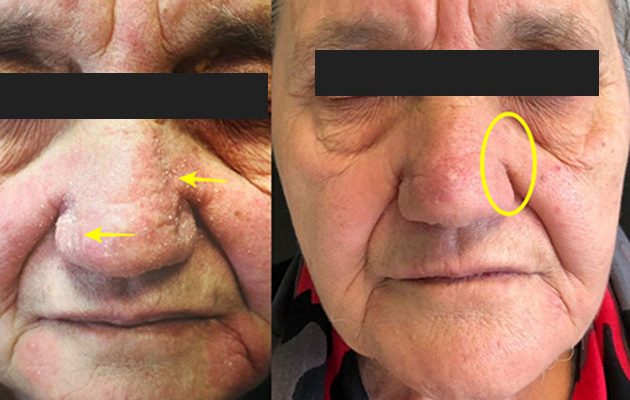
In uno studio condotto presso la UOSD di Dermatologia del Policlinico di Roma Tor Vergata, sono stati valutati 20 pazienti affetti da dermatite seborroica in forma moderata e severa del volto, che hanno utilizzato una formulazione topica di GSH-C4 allo 0.4% una volta al giorno per un mese. Il trattamento ha favorito la remissione clinica della dermatosi, con un elevato profilo di tollerabilità. Il GSH-C4 ha dimostrato un’ azione cortison-like, riducendo l’infiammazione cutanea ed il prurito senza effetti avversi locali.
Referenze
- Mazzilli S, Cosio T, Botti E, et al. Dimethylfumarate efficacy and safety in palmoplantar psoriasis patient affected by hepatitis b and depression: A case report. Dermatol Ther. 2020;33(4):e13659. doi:10.1111/dth.13659
- Campione E, Mazzilli S, Lanna C, et al. The Effectiveness of a New Topical Formulation Containing GSH-C4 and Hyaluronic Acid in Seborrheic Dermatitis: Preliminary Results of an Exploratory Pilot Study. Clin Cosmet Investig Dermatol. 2019;12:881-885. Published 2019 Dec 16. doi:10.2147/CCID.S231313
- Palamara AT, Brandi G, Rossi L, et al. New synthetic glutathione derivatives with increased antiviral activities. Antivir Chem Chemother. 2004;15:83–91. doi:10.1177/095632020401500204
- Limongi D, Baldelli S, Checconi P, et al. GSH-C4 acts as anti-inflammatory drug in different models of canonical and cell autonomous inflammation through NFκB inhibition. Front Immunol. 2019;10:155. doi:10.3389/fimmu.2019.00155
- Filomeni G, Rotilio G, Ciriolo MR. Cell signalling and the glutathione redox system. Biochem Pharmacol. 2002;64:1057–1064. doi:10.1016/s0006-2952(02)01176-0